

© 2022 莱奥德创 版权所有
蛋白质治疗药物的保质期维持是核心挑战。理想中的蛋白质配方应能抵御加工和运输中的干扰,室温下保持24个月稳定。然而,蛋白质易受化学(如脱酰胺、氧化)和物理(如聚合)降解影响,导致生物活性降低和/或副作用增多。液体配方中,蛋白质易因水参与而降解,且液体对温度波动敏感,需要小心防止意外加热或冻结。当液体配方无法满足稳定性和保质期要求时,常采用冻干法。
采用“冻干法”的优缺点
虽然制备冻干蛋白过程昂贵、耗时,并且是分批处理,但相比液体配方,冻干具有明显优势。冻干蛋白在运输和处理中不易受机械应力影响,因为去除了空气-水界面。干燥状态下,蛋白质翻译运动减少,降低了蛋白质碰撞和聚集的可能性。此外,适当的冻干制剂还能提高化学稳定性。
如何优化制备冻干蛋白过程?
冻干过程可能对蛋白质造成损害,因为蛋白质在冻干过程中会面临多种压力,如热力学不稳定性、高盐浓度、表面相互作用、冻结诱导的pH波动和干燥过程中的机械应力。为保护蛋白质,需添加稳定其结构的辅料。目前的研究对辅料在冷冻步骤中保护蛋白质的理解较为完整,在储存和复水阶段辅料的相分离的影响可能同样重要,但目前知之甚少。
本文将重点探讨辅料相分离在冷冻和干燥过程中对蛋白质稳定性的影响。
辅料在冷冻和干燥中需满足许多标准:
1-通过冷冻和干燥这两个步骤来稳定蛋白质结构;
2-干燥的辅料必须形成玻璃状固体,其干态玻璃化转变温度高于计划的储存条件;
3-可能有特定的化学降解途径,必须通过添加适当的辅料或排除某些污染物(如金属)来抑制。
一、冻结过程中的稳定
在一个冻干循环的冷冻部分,蛋白质溶液被装入玻璃小瓶中并放入冻干器进行冷却。当溶液冷却到低于冰点时,纯冰开始结晶,使剩余成分浓缩。非冰相中的组分可能因浓度过高而沉淀或保持过饱和状态。同时,随着冻结浓度的增加,粘度增大,可能形成玻璃状基质。如果赋形剂是聚合物,当聚合物被水分子水合至其重量的20%-30%时,会发生玻璃化转变。
在冻结过程中,蛋白质受到的压力可分为三大类:
表面诱导效应
表面引起的损伤可能是由于存在大量的冰/水界面或小瓶蛋白相互作用,并可通过添加非离子表面活性剂来还原或阻止。
浓度效应
浓度效应的产生是因为冻结浓缩了所有的非冰相,潜在地将溶液组分的浓度提高到不稳定的水平。
温度诱导的热力学效应
低温对蛋白质构象的稳定性也有影响。
如何减轻低温对稳定性的影响?
添加剂,如甘油和多羟基化合物,能减轻低温对稳定性的影响。这种稳定作用可通过Timasheff和Arakawa提出的一般热力学机制理解,即优先水化。在非冷冻和冷冻溶液中,溶质可诱导蛋白质稳定。
Timasheff机制指出,稳定剂在蛋白质表面呈现负吸附等温线,即它们被优先排除在蛋白质表面之外。这种负吸附与蛋白质化学势的增加有关,而变性蛋白质的化学势增加更大,导致更紧凑的自然状态。因此,聚合物辅料如2-甲基2、4-戊二醇(MPD)和聚(乙二醇)(PEG)可作为有效的低温保护剂。同时,其他保护剂如糖、多元醇、氨基酸和“盐析”无机盐也通过优先水合机制发挥作用。
Timasheff机制预测,为了最小化化学势,蛋白质的表面积被最小化,有利于紧凑的自然状态。然而,如果蛋白质聚集,蛋白质的溶胶环境表面积可进一步减少。因此,预测多元醇或糖将保护天然蛋白质结构的相同机制也预测,在较高的赋形剂浓度下,天然状态的化学势将充分增加,从而导致蛋白质从溶液中沉淀。例如,稳定蛋白质(硫酸铵,聚乙二醇)也可用作沉淀剂。PEG诱导的蛋白质沉淀可用于预配方开发的早期阶段来估计蛋白质的溶解度。体积排斥诱导的相分离在生物学和生物技术中普遍存在,被认为是细胞质中微分隔的基础。
二、干燥过程中的稳定
冻干循环的干燥部分可分为两部分:一次干燥和二次干燥。在一次干燥过程中,系统压力降低,使冰晶升华。必须注意保持样品温度低于非晶相的玻璃化转变温度,以避免不希望的饼塌。一次干燥完成后,除去与非晶相相关的水。在二次干燥过程中去除水会提高玻璃化转变温度,因此,只要样品温度保持低于其玻璃化温度,就可以提高系统温度以加快干燥速度。在二次干燥结束时,玻璃化转变温度应该足够高,以允许所需的储存条件(如室温)下不坍塌。

不幸的是,即使有防止冷冻损伤的辅料,干燥周期也会对蛋白质构象稳定性构成威胁。维持蛋白质天然构象的必要条件是一种赋形剂,干燥后形成玻璃无定形固体。有研究提出了基于玻璃固体中机械固定化的蛋白质保护机制,该机制通过玻璃固体的高粘度充分固定蛋白质,阻碍其运动和松弛过程,从而防止聚集、展开和化学降解反应。另一种机制表明,干燥保护剂(如糖和多元醇)可取代移除水时形成的氢键,起到保护作用。
这两种解释均未被证明是完全正确的,许多蛋白质在冻干过程中会展开,即使存在辅料也会形成玻璃。例如,白细胞介素1受体拮抗剂在含有1%—4%蔗糖的溶液中会展开,但在5%—10%的蔗糖浓度下则不会。而聚乙烯吡咯烷酮(PVP)和牛血清白蛋白虽被认为可阻止氢键的有效取代,但它们都能在冻干和复水过程中保护四聚酶天冬酰胺酶、乳酸脱氢酶和磷酸果糖激酶。
三、冷冻和干燥过程中相分离的影响
缓冲盐在蛋白质制剂中的相行为—缓冲盐在蛋白质制剂中通常用于控制pH,从而最大限度地减少蛋白质降解反应,在灌装操作过程中减少蛋白质聚集,并保持最终复溶后溶液的等渗性。但冻结时,缓冲盐会浓缩,对蛋白质结构产生不可预测的影响。如图1所示,在其共晶温度为-21°C时,在冻结前从150mM开始的等渗NaCl溶液的浓度将增加到3.6M。高浓度可能损害蛋白质,而冷冻浓缩导致缓冲盐沉淀会加剧不利影响。例如,Na₂HPO₄的共晶温度为-2°C,冻结磷酸钠缓冲系统可能导致二碱基形式结晶,留下高浓度的单碱基盐,导致非冰相pH值很低,破坏蛋白质结构稳定。
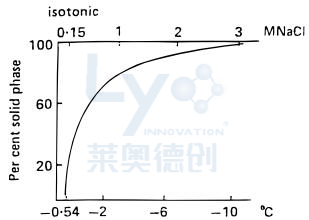
图1:等渗(0.9% w/w)NaCl溶液的冻结浓度
如何防止/抑制结晶?
缓冲盐结晶的预测具有挑战性,因为其他赋形剂可能抑制其结晶。例如,15mg/mL的糖(葡萄糖、乳糖、蔗糖、海藻糖)能防止100mM NaCl溶液在冻结时结晶,但稍高浓度的聚合物(PEG 100、Dextran 11000MW、PVP 40000MW、Ficoll 400000MW)也可以达到相同程度的抑制。
同样多种辅料(葡聚糖、蔗糖、山梨醇、乳糖、海藻糖、Taps)可防止或部分阻止Na₂HPO₄的结晶。扩展相图已经发表,其中包含了H₂O-NaCl-甘油和H₂O-NaCl-羟乙基淀粉体系的非平衡行为。对于大多数冻干方案中典型的辅料和冷却速率,这种扩展或“动态”相数据是不可用的,必须从差示扫描量热法(DSC)中逐个获得。

DSC模块
冻干制剂中加入疏松剂的注意事项
疏松剂通常被添加到冻干制剂中以保存蛋白质结构,并防止蛋白质在冻干过程中失活,同时提高制剂的美观性。疏松剂还可以作为调性调节剂。甘氨酸和甘露醇是两种常用的蛋白质稳定剂,但通常不够有效,因为它们容易与蛋白质分离。添加其他辅料,如磷酸钾,可以改变结晶趋势,使甘露醇保持无定形,从而保护乳酸脱氢酶。值得注意的是,据报道,含有100-500mM甘露醇的溶液中冻干的样品中,乳酸脱氢酶活性低于单独在缓冲液中干燥的样品(图2)。虽然未明确报道活性丧失的原因,但推测可能与甘露醇晶体提供的额外表面积有关。一项类似的研究表明添加甘氨酸可以抑制甘露醇和甘氨酸的结晶,形成非晶态制剂,保护人体生长激素。甘氨酸结晶模式复杂,受pH和离子强度影响,可冷冻干燥形成多态。
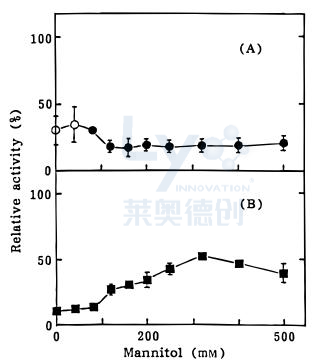
图2:(A)冻干/(B)解冻后乳酸脱氢酶(LDH)的相对活性。样品包含20 mg/ml LDH和不同含量的甘露醇在50mM磷酸钠缓冲液,pH 7.4,冷冻并在−20°C保存1小时,然后冷却到−40°C和(A)冻干或(B)解冻。
对于易结晶的疏松剂,储存时的意外结晶对其长期稳定性具有破坏性影响。非晶态甘露醇在约45°C时会结晶,一旦样品温度升至该点以上,甘露醇将形成无水晶体,释放与非晶相相关的水,降低剩余非晶相的玻璃化转变温度,可能导致粉饼的坍塌。因此,含有这种可结晶辅料的制剂应通过退火(如提高温度以允许完全结晶)或添加其他成分来稳定。
关于蛋白质表面会排除溶质
保护性辅料的结晶对玻璃固定化机制和水替代假说的共同要求是赋形剂与蛋白质保持密切接触。否则,赋形剂无法在干燥和储存过程中与蛋白质形成氢键结合或机械保护。与冷冻过程相反,好的冷冻保护剂是最被排除在蛋白质表面的。
因此,我们可以预测,像聚乙二醇这样的优秀的低温保护剂可能在干燥过程中无法保护蛋白质,事实已经证明情况确实如此。图3中的数据表明,虽然1%的PEG 8000可以保护乳酸脱氢酶免受解冻损伤,但对干燥诱导的变性几乎没有保护作用,磷酸果糖激酶也有类似结果。干燥样品的量热分析显示,聚乙二醇被排除在表面蛋白质,无法形成保护玻璃或取代水氢键。PEG不能保护多种蛋白质抵抗冻干诱导的展开。另一研究表明,通过添加糖阻止聚乙二醇相分离,可在冻干过程中保护乳酸脱氢酶结构。
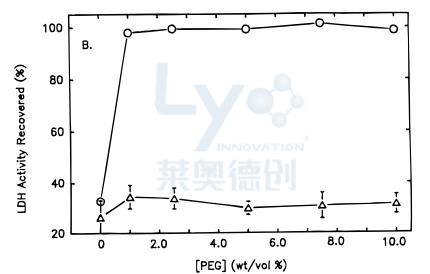
图3:聚乙二醇(PEG)对乳酸脱氢酶(LDH)稳定性的影响。(〇)解冻过程中的稳定性;(∆)冷冻干燥过程中的稳定性。样品含有25 mg/mL LDH的 10mM磷酸钾缓冲液,pH 7.5。
蛋白质表面排除溶质对低温保护有益,但在干燥过程中不受保护,引发了一个问题:
为什么低分子量溶质,如双糖,通常被排除在蛋白质表面,对冷冻和干燥损伤都有效?
尽管答案仍在研究中,但有两种可能的解释:
高分子量的聚合物,如PEG,与较小的双糖相比,在蛋白质表面的浓度更低。排除并不意味着界面上完全没有赋形剂,而是浓度更低。因此,在冷冻过程中提供相同保护所需的双糖浓度将高于聚合物体系;
其次,低分子量辅料比大分子具有更快的弛豫动力学。因此,在冷冻过程中被排除在外的双糖在干燥过程中可能仍能与蛋白质表面相互作用。
需要注意的是,蛋白质本身可能影响保护性辅料的结晶或保持无定形倾向。例如,牛生长激素可以抑制冻干制剂中蔗糖的结晶,因为蔗糖结晶将水释放成非晶相,不利于储存的稳定性。有趣的是,添加高浓度的牛生长激素(高达20%)提高了蔗糖结晶所需的温度,但对玻璃化转变温度没有显著影响。因此,使用高蛋白质浓度可作为在运输过程中保护配方免受短暂温度波动影响的策略。
关于非晶相分离
非晶相分离指的是在冻结过程中,非冰相内液-液相之间可能发生分离的现象。许多聚合物-聚合物和聚合物-盐对在室温溶液中可形成两个水相,高盐浓度下蛋白质会从普通盐中相分离。这些化合物如聚乙二醇、PVP、右旋糖酐、纤维等,可作为冷冻保护剂和冻干剂。热力学不相容导致辅料表面蛋白质强烈排除,同时提供理想的保护对抗冻伤。冷冻浓度期间,通过体积排斥机制可能导致液-液相分离。冷冻浓度可能很大,导致非冰相赋形剂浓度大到足以裂解,比结晶事件更难检测,但差示扫描量热法(DSC)可确认其存在。在含有PVP和磷酸钠的体系中发现了冻液浓度诱导的液-液相裂解的例子。具有两种玻璃化转变温度的系统是相分离样品的特征。如图4 DSC图谱所示,同时含有右旋糖酐和纤维醇或右旋糖酐和PVP的溶液可以检测到多种玻璃化转变。
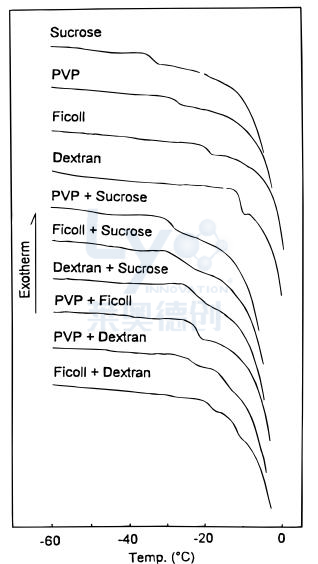
图4:含有各种糖、聚合物及其混合物的冷冻溶液的DSC图谱。PVP−右旋糖酐和Ficoll−右旋糖酐混合物出现多个玻璃化转变。
由于冻结浓度导致的相分离,形成多个非晶相,不仅限于聚合物或其他高分子化合物。Akers等人发表了甘氨酸和氯化钠冷冻溶液的DSC热图,显示出多个玻璃化转变。这些非晶相的组成尚未确定。但添加0.8M氯化钠到10%中性甘氨酸时,出现两个玻璃转变,暗示可能存在高浓度NaCl和低浓度NaCl相。
由于系统平衡,血红蛋白的化学势在各相中相同。傅里叶变换红外(FTIR)分析显示,两相之间血红蛋白结构无差异。当这两相被冻结时,血红蛋白的构象有所改变,但在高浓度PEG相和高浓度葡聚糖相冻结的血红蛋白之间没有可检测到的结构差异,这支持了冻结期间的结构扰动是由Timasheff的优先排斥机制控制的假设。
图5展示了含有8%聚合物的样品(图5中第3点)。在0°C下,该体系为单相,但冷冻浓度增加到10%时,可能促进相分离。冻干后,血红蛋白结构受到严重破坏,扫描电子显微镜(SEM)分析显示聚乙二醇/右旋糖酐混合物因冷冻浓度而分离。相分离本身可能是造成这种损害的原因之一,且比单独在缓冲盐中干燥蛋白质的影响更严重。然而,在室温或冷却过程中发生相分离时,血红蛋白的结构完整性更佳。可能的原因包括聚乙二醇/右旋糖酐界面形成大量新表面积以及在干燥过程中两相差异收缩产生的机械应力。
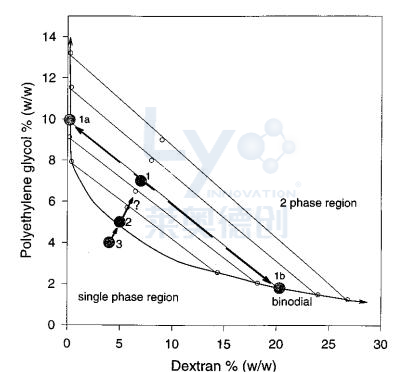
图5:PEG4000−葡聚糖T500在0°C下的相图。曲线左边的点在单相区域,曲线右边的点在两相区域。点1:7%PEG−7%右旋糖酐体系;点2和点3:5% PEG−5%右旋糖酐和4% PEG−4%右旋糖酐体系。
四、结论
在冷冻过程中,相分离可能影响蛋白质的保护作用,而传统的DSC或SEM技术难以检测到。因此,相分离可能是冻干样品中蛋白质稳定的玻璃固定化解释不成立的原因之一。Pikal提出的玻璃化固定化假说的一个修正版本表明,赋形剂不仅形成化学惰性玻璃,还与蛋白质形成单相,以抵抗分离并防止蛋白质变性。在这个版本中,氢键替换是稳定的充分但不必要条件。在冻干过程中,辅料稳定蛋白质的“水替代”假说只是一个更广泛的假说的特殊情况,我们可以称之为“单相玻璃”假说。
莱奥德创冻干技术分享
扫码关注公众号 “莱奥德创冻干工场”,点击菜单栏“冻干讲堂”,立即获取更多冻干线上技术分享内容。
